Los instrumentos que se utilizan para la técnica de PCR a tiempo real consisten en:
- un termociclador,
- un sistema óptico (para emitir y detectar fluorescencia),y
- un sistema informático (hardware y software) para la adquisición y análisis de datos.
- formato de los pocillos de reacción,
- longitudes de onda de emisión y excitación,
- tipo de química que se puede utilizar,
- software,
- rapidez,
- aplicaciones,
- etc.
Existen multitud de referencias bibliográfica que hacen unas muy buenas recopilaciones de todos estos equipos (como por ejemplo Logan J.M.J and Edwards K.J., An overview of PCR platfforms - En Real-time PCR: current technology and applications).
A continuación pasaremos a describir brevemente cada uno de los componentes de estos instrumentos.
Termociclador
Es el primer componente a considerar en un equipo de PCR a tiempo real. De hecho, una buena reacción de PCR dependerá de la precisión en la regulación de la temperatura en los pocillos de reacción y de la rapidez a la que se alcanzan las temperaturas programadas.
http://jblabsac.blogspot.com.es/2010/04/los-sensores-en-su-termociclador.htmlLa mayoría de los equipos utilizan tecnologías basadas en el enfriamiento-calentamiento mediante efecto Peltier (ver figura). Aunque también existen compañías que prefieren el uso de la tecnología patentada Therma-base, aire caliente, etc.
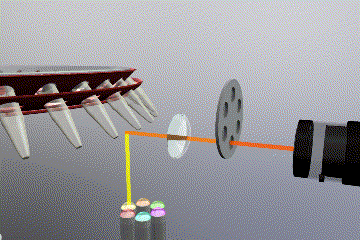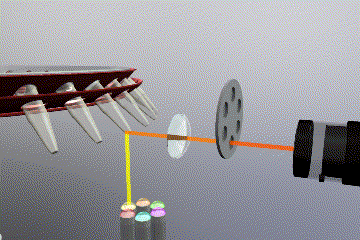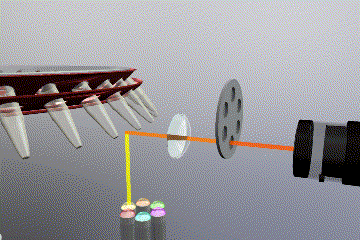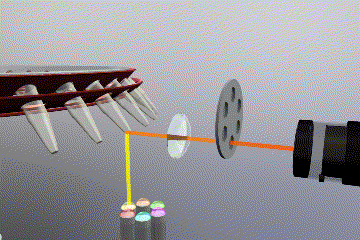
Sistema óptico
Como es de esperar, es necesario un sistema fluorimétrico integrado en el equipo para detectar y monitorizar los niveles de fluorescencia durante la reacción de PCR. En este caso también existen varias opciones disponibles tanto para la fuente de emisión como para el sistema detección de fluorescencia.
Las fuentes de emisión que producen la excitación del fluoróforo pueden clasificarse en:
- lámparas de tungsteno o cuarzo-tungsteno: en este caso el equipo dispone de una serie de filtros que seleccionan la longitud de onda deseada. Si nuestro equipo dispone de este tipo de fuentes de emisión, y en el caso de usar varios fluoróforos a la vez, debemos elegir fluoróforos que tengan sus espectros de emisión muy separados.
 |
| http://blog.biosearchtech.com/TheBiosearchTechBlog/?Tag=Multiplexing%20qPCR |
- diodos emisores de luz (LED) los equipos disponen de varios emisores LEDs que excitan a diferentes longitudes de onda, proporcionando una mayor selección de fluoróforos.
- láser.
En lo referente a los detectores utilizados se establecen para medir bandas estrechas del espectro, aunque algunos equipos permiten la posibilidad de añadir filtros que pueden ser personalizados por el usuario. El número de canales de detección que son efectivos depende de el rango de longitudes de onda de excitación disponible.
A medida que la tecnología ha avanzado, se han ido desarrollando equipos de PCR a tiempo real de segunda, tercera y cuarta generación. Las mejoras consistían en el aumento de las capacidades de rendimiento y multiplexación. Por supuesto, las características ópticas de un equipo tienen un impacto directo en la capacidad de multiplexación y también en determinar qué sistema de sondas son compatibles. Es importante señalar que el equipo y la elección de la química fluorescente están fuertemente ligados. En efecto, algunos equipos están limitados al uso de un sistema de sondas en particular y mientras que la óptica del sistema son capaces de excitar y detectar diferentes químicas fluorescentes, a menudo el software que analiza los datos no lo está, y el usuario necesita exportar los datos a un programa de hojas de cálculo para un análisis más detallado.
Otras características
Muchas de las plataformas utilizan un formato de bloque estándar de 96 pocillos o bien uno intercambiable de 384 pocillos, que ofrecen un medio - alto rendimiento. El uso de utilizar un formato de bloque es que también pueden utilizarse placas estándar de PCR y tubos, que suelen ser mas baratos que los plásticos específicos para cada instrumento.
En lo referente al software, idealmete debe tener un entorno lo más amigable posible pero también es importante comprobar que es capaza de analizar completamente los resultados de la química fluorescente elegida. Como ya hemos mencionado, algunos equipos de PCR a tiempo real se encuentran limitados debido al uso de ciertas químicas fluorescentes. De hecho, algunos poseen un software específco para diseñar los primer y las sondas. Este software ayuda a simplicar y agilizar el proceso de diseño de los ensayos puesto que, está optimizado para un equipo y reactivos concretos.
Claramente, la PCR a tiempo real a tenido un desarrollo significativo en los últimos 15 años, dando lugar a una gran variedd de plataformas.
En lo referente al software, idealmete debe tener un entorno lo más amigable posible pero también es importante comprobar que es capaza de analizar completamente los resultados de la química fluorescente elegida. Como ya hemos mencionado, algunos equipos de PCR a tiempo real se encuentran limitados debido al uso de ciertas químicas fluorescentes. De hecho, algunos poseen un software específco para diseñar los primer y las sondas. Este software ayuda a simplicar y agilizar el proceso de diseño de los ensayos puesto que, está optimizado para un equipo y reactivos concretos.
Consideraciones finales
A la hora de tener en cuenta los pros y los contras de los diferentes equipos para su elección en un laboratorio, debemos tener en cuenta factores como: la química fluorescente que permiten utilizzar, la capacidad de multiplexación para esas químicas, el rendimiento, la flexibilidad, el formato, la robustez y facilidad de uso del software, la reproducibilidad, la rapidez, el tamaño, el soporte técnico, el soporte el usuario y finalmente, aunque no menos importante, el coste, no solo del equipamiento inicial sino también de los consumibles y reactivos. También sería deseable poder "probar antes de comprar", y ya algunas compañías lo tienen en cuenta.Claramente, la PCR a tiempo real a tenido un desarrollo significativo en los últimos 15 años, dando lugar a una gran variedd de plataformas.